NCCN vodič – lečenje i suportivna terapija
Hronična limfocitna leukemija (HLL) i sitnoćelijski limfom (SLL) suštinski su dve manifestacije iste bolesti koje se leče na sličan način. Identifikovan je veliki broj molekularnih i citogenetskih varijabli sa prognostičkim implikacijama. Minimalna rezidualna bolest koja se ne može detektovati na kraju lečenja hemoimunoterapijom ili kombinovanim režimima zasnovanim na venetoklaksu je nezavisni prediktor poboljšanog preživljavanja među pacijentima sa prethodno nelečenom bolešću ili relapsnom/refraktornom HLL/SLL. Izbor tretmana se zasniva na stadijumu bolesti, prisustvu ili odsustvu mutacije del(17p) ili TP53, mutacionom statusu varijabilnog regiona teškog lanca imunoglobulina, starosti pacijenta, performans statusu, komorbiditetima i toksikološkom profilu lekova.
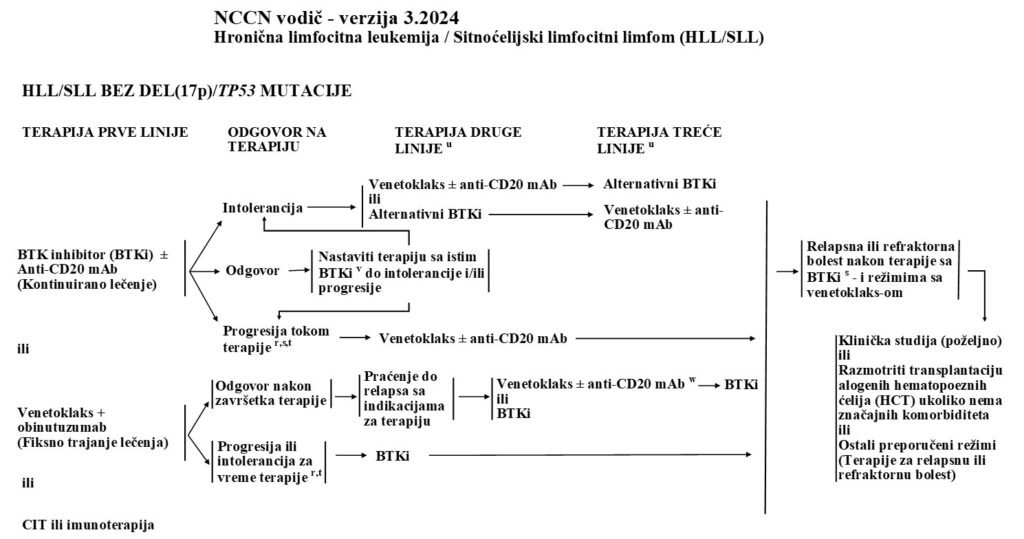
s Testiranje na BTK i PLCG2 mutacije može biti korisno kod pacijenata sa progresijom bolesti ili bez odgovora dok su na BTKi terapiji, uključujući i to ako se loše terapijska adherenca smatra mogućim uzrokom. BTK i PLCG2 mutacioni status sam po sebi nije indikacija za promenu terapije u odsustvu progresije bolesti. Alternativni kovalentni BTKi (akalabrutinib, ibrutinib ili zanubrutinib) može se razmotriti za intoleranciju u odsustvu progresije bolesti.
t Razmotriti mogućnost histološke transformacije kod pacijenata sa progresivnom bolešću. Preporučuje se biopsija da bi se potvrdila histološka transformacija.
u Kod pacijenata sa bolešću koja reaguje na terapiju: Nastaviti sa istim BTKi do progresije i/ili intolerancije. Ako se leči tretmanom sa fiksnim trajanjem na bazi venetoklaksa, pratiti do relapsa sa indikacijama za ponovno lečenje. U vreme progresije bolesti, preći na sledeću terapiju što je pre moguće. Interval bez terapije treba da bude što kraći. Bezbedno je preklapati se sa venetoklaksom dok traje BTKi terapija.
v Kod pacijenata bez intolerancije, ibrutinib se može nastaviti do progresije bolesti uz poštovanje preporučenih smernica za modifikaciju doze po potrebi.
w Preferira se venetoklaks + obinutuzumab
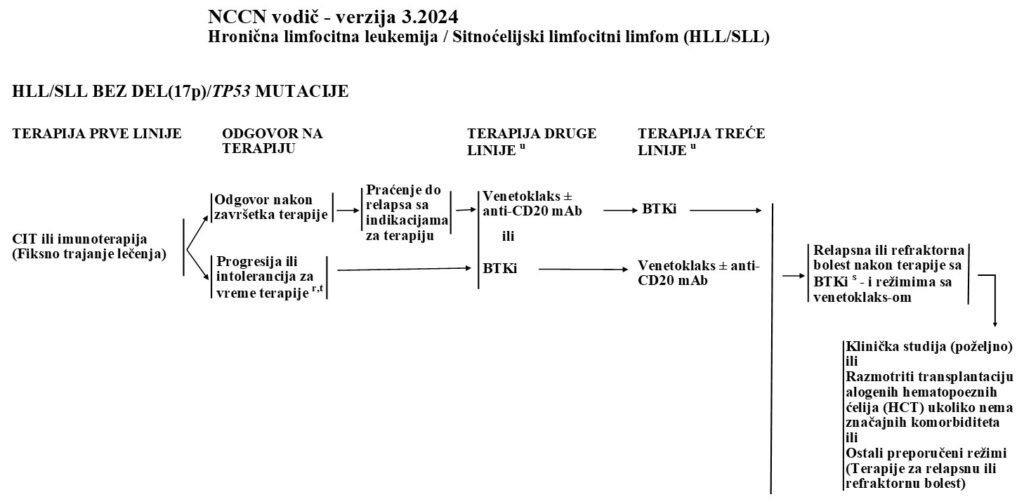
s Testiranje na BTK i PLCG2 mutacije može biti korisno kod pacijenata sa progresijom bolesti ili bez odgovora dok su na BTKi terapiji, uključujući i to ako se loše terapijska adherenca smatra mogućim uzrokom. BTK i PLCG2 mutacioni status sam po sebi nije indikacija za promenu terapije u odsustvu progresije bolesti. Alternativni kovalentni BTKi (akalabrutinib, ibrutinib ili zanubrutinib) može se razmotriti za intoleranciju u odsustvu progresije bolesti.
t Razmotriti mogućnost histološke transformacije kod pacijenata sa progresivnom bolešću. Preporučuje se biopsija da bi se potvrdila histološka transformacija.
u Kod pacijenata sa bolešću koja reaguje na terapiju: Nastaviti sa istim BTKi do progresije i/ili intolerancije. Ako se leči tretmanom sa fiksnim trajanjem na bazi venetoklaksa, pratiti do relapsa sa indikacijama za ponovno lečenje. U vreme progresije bolesti, preći na sledeću terapiju što je pre moguće. Interval bez terapije treba da bude što kraći. Bezbedno je preklapati se sa venetoklaksom dok traje BTKi terapija.
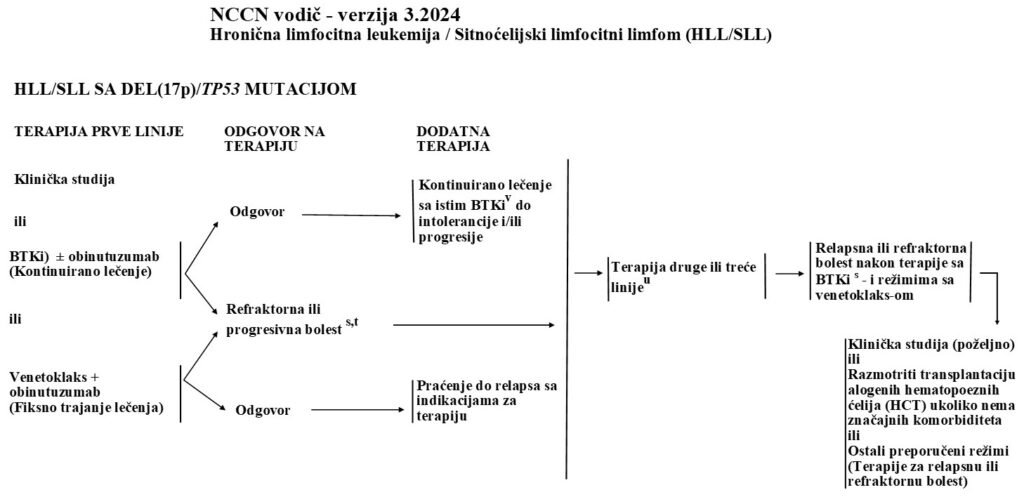
t Razmotriti mogućnost histološke transformacije kod pacijenata sa progresivnom bolešću. Preporučuje se biopsija da bi se potvrdila histološka transformacija.
u Kod pacijenata sa bolešću koja reaguje na terapiju: Nastaviti sa istim BTKi do progresije i/ili intolerancije. Ako se leči tretmanom sa fiksnim trajanjem na bazi venetoklaksa, pratiti do relapsa sa indikacijama za ponovno lečenje. U vreme progresije bolesti, preći na sledeću terapiju što je pre moguće. Interval bez terapije treba da bude što kraći. Bezbedno je preklapati se sa venetoklaksom dok traje BTKi terapija.
v Kod pacijenata bez intolerancije, ibrutinib se može nastaviti do progresije bolesti uz poštovanje preporučenih smernica za modifikaciju doze po potrebi
PROGNOSTIČKE INFORMACIJE ZA HLL/SLLa
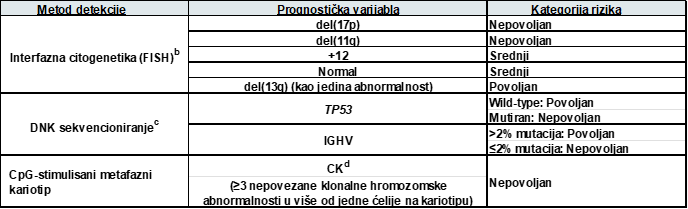
b Formalna istraživanja koja identifikuju procenat abnormalnih ćelija koje je identifikovao FISH su u toku, iako izgleda da na populaciji manjoj od 10% nije nađen klinički uticaj kao što je navedeno u tabeli. Prisustvo del(11k) i/ili del(17p) povezano je sa kratkim preživljavanjem bez progresije (PFS) sa hemoterapijom i CIT pristupima.
c IGHV rearanžmani koji uključuju VH3-21 imaju lošu prognozu čak i ako su mutirani. Mutacioni status TP53 takođe pruža dodatne prognostičke informacije za FISH.
d CK je zasnovan na rezultatima metafazne kariotipizacije CpG-stimulisanih HLL ćelija.
HLL SISTEM KLASIFIKACIJE STADIJUMA
Rai sistema

Binet sistemb

b Od: Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981;48:198-206.
c Imunski posredovane citopenije nisu osnova za ove definicije stadijuma.
HLL SISTEM KLASIFIKACIJE STADIJUMA
Lugano modifikacija Ann Arbor klasifikacije stadijumad
(za primarne nodalne limfome)
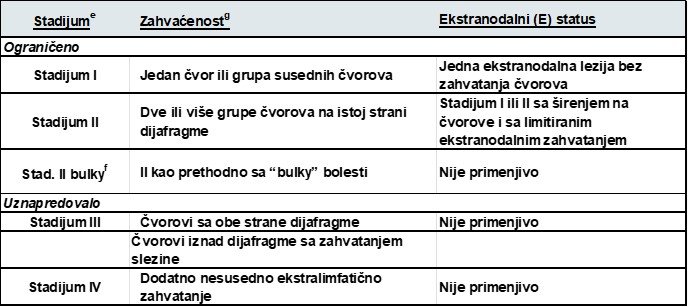
e Kategorizacija A naspram B je uklonjena iz Lugano modifikacije Ann Arbor sistema za određivanje stadijuma bolesti.
f Histološkim pregledom i brojnim prognostičkim faktorima moguće je odrediti treba li se stadijum II “bulky” lečiti kao ograničena ili uznapredovala bolest.
g Napomena: Krajnici, Valdejerov prsten i slezina se smatraju limfnim nodalnim tkivom.
SUPORTIVNA TERAPIJA ZA PACIJENTE SA HLL/SLL






B-ćelija, pacijenti generalno ne reaguju na vakcinu protiv gripa i ako se daju ne treba ih smatrati
vakcinisanim.
PREDLOŽENI REŽIMI LEČENJAa,b,c,d
HLL/SLL bez del(17p)/TP53 mutacije
(abecedno po kategorijama)

HLL/SLL bez del(17p)/TP53 mutacije


** Nekovalentni (reverzibilni) BTKi
HLL/SLL sa del(17p)/TP53 mutacijom
(abecedno po kategorijama)
CIT se ne preporučuje jer je del(17p)/TP53 mutacija povezana sa lošim terapijskim odgovorima.

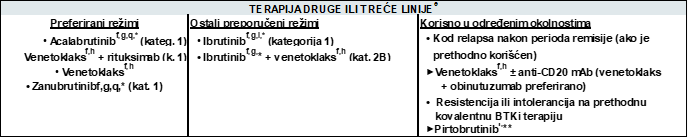

PREDLOŽENI REŽIMI LEČENJA – FUSNOTE
a Pogledajte reference za režime na CSLL-D 5 od 6 i CSLL-D 6 od 6.
b Podrška za pacijente sa HLL/SLL (CSLL-C).
c Injekcija rituksimaba i hijaluronidaze za subkutanu upotrebu mogu se koristiti kod pacijenata koji su primili najmanje jednu punu dozu rituksimaba intravenskim putem.
d Ponovno davanje istog mAb se ne preporučuje kod pacijenata koji imaju retke komplikacije (npr. mukokutane reakcije uključujući paraneoplastični pemfigus, Stevens-Johnsonov sindrom, lihenoidni dermatitis, vezikulobulozni dermatitis i toksičnu epidermalnu nekrolizu). Nije jasno da li ponovno davanje alternativnog anti-CD20 mAbs predstavlja isti rizik od recidiva.
e Biosimilar koji je odobrila FDA je odgovarajuća zamena za rituksimab.
f Molimo pogledajte uputstvo za upotrebu za potpune informacije o propisivanju, modifikaciji doze i praćenje neželjenih reakcija: : https://www.accessdata.fda.gov/scripts/cder/ daf/index.cfm.
g Pre početka davanja kovalentnog BTKi treba razmotriti početnu procenu kardiovaskularnog rizika.
h Venetoclax: Recommended TLS Prophylaxis and Monitoring Based on Tumor Burden (CSLL-F).
i Konsenzus panela da se ibrutinib navede pod „drugim preporučenim režimima“ zasniva se na profilu toksičnosti.
j Preporučuje se samo za pacijente mlađe od 65 godina bez značajnih komorbiditeta.
k Podaci iz studije HLL10 potvrdili su superiornost FCR u odnosu na bendamustin + rituksimab (BR) kod mlađih pacijenata. Za pacijente >65 godina, ishod je bio sličan za oba režima sa manje mijelosupresije i infekcije za BR. FCR je bio povezan sa poboljšanim PFS (sa PFS platoom nakon 10-godišnjeg praćenja) kod pacijenata sa mutiranim IGHV bez del (17p)/TP53 mutacije (Thompson P, et al. Blood 2016; 127:303-309).
l AIHA ne bi trebalo da isključi upotrebu kombinovane terapije koja sadrži fludarabin; međutim, pacijente treba pažljivo posmatrati i izbegavati fludarabin kod onih kod kojih se sumnja na AIHA povezanu sa fludarabinom.
m Za pacijente stare ≥65 godina ili pacijente starosti <65 godina sa značajnim komorbiditetima (CrCl <70 mL/min) doza je 70 mg/m2 u ciklusu 1 sa eskalacijom do 90 mg/m2 ako se toleriše.
n Anti-CD20 mAbs uključuju: rituksimab ili obinutuzumab.
o Ne preporučuje se za pacijente oslabljenog zdravstvenog stanja.
p Preporučuje se samo za pacijente stare ≥65 godina ili pacijente mlađe od 65 godina sa značajnim komorbiditetima (klirens kreatinina [CrCl] <70 mL/min).
q Akalabrutinib ili zanubrutinib se nisu pokazali efikasnim za HLL otpornu na ibrutinib sa mutacijama BTK C481S. Pacijenti sa intolerancijom na ibrutinib su bili uspešno lečen akalabrutinibom ili zanubrutinibom bez ponavljanja simptoma.
r Pogledajte uputstvo za pakovanje za potpune informacije o propisivanju, modifikaciji doze i praćenju neželjenih reakcija: https://www.fda.gov/media/145711/download. Takođe pogledajte Toksičnosti povezane sa CAR T-ćelijama u NCCN smernicama za upravljanje toksičnostima povezanih sa imunoterapijom za upravljanje sindromom oslobađanja citokina (CRS) i upravljanje neurološkom toksičnošću.
s Indikovan za pacijente za koje bi se monoterapija rituksimabom smatrala prikladnom zbog prisustva drugih komorbiditeta (smanjena bubrežna funkcija merena CrCl <60 mL/min, ili NCI CTCAE stepen ≥3 neutropenije ili stepen ≥3 trombocitopenija kao rezultat mijelotoksičnih efekata prethodna terapija citotoksičnim agensima).
t Lenalidomid se može davati kroz kontinuirano ili povremeno doziranje za pacijente sa HLL. Faktori rasta i/ili prilagođavanje doze mogu biti potrebni za rešavanje citopenije, bez potrebe za zaustavljanjem lečenja. Videti Andritsos L, et al. J Clin Oncol 2008;26:2519-2525; Vendtner C, et al. Leuk Limphoma 2016; 57: 1291-1299.
u Iako alemtuzumab više nije komercijalno dostupan za HLL, može se nabaviti za kliničku upotrebu. Alemtuzumab je manje efikasan za “bulky” (>5 cm) limfadenopatiju; pratiti reaktivaciju CMV. Videti Tretman i virusna reaktivacija (CSLL-C 1 od 4).
Izvor: Wierda WG, Brown J, Abramson JS, Awan F, Bilgrami SF, Bociek G, Brander D, Cortese M, Cripe L, Davis RS, Eradat H, Fakhri B, Fletcher CD, Gaballa S, Hamid MS, Hill B, Kaesberg P, Kahl B, Kamdar M, Kipps TJ, Ma S, Mosse C, Nakhoda S, Parikh S, Schorr A, Schuster S, Seshadri M, Siddiqi T, Stephens DM, Thompson M, Ujjani C, Valdez R, Wagner-Johnston N, Woyach JA, Sundar H, Dwyer M. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma, Version 2.2024, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2024 Apr;22(3):175-204. doi: 10.6004/jnccn.2024.0018. PMID: 38626800.


