ESMO vodič dobre kliničke prakse (CPG) je ažuriran novim preporukama za lečenje i ažuriranim algoritmima za lečenje rane i uznapredovale bolesti: Hronična limfocitna leukemija: ESMO vodič dobre kliničke prakse (CPG) za dijagnozu, lečenje i praćenje.
Originalni vodič dobre kliničke prakse (CPG) pogledajte ovde: https://www.esmo.org/guidelines/guidelines-by-topic/haematological-malignancies/chronic-lymphocytic-leukaemia.
Izdvojeno/ključno
- Ažuriranje obuhvata odobrenje za vremenski ograničenu primenu kombinacije ibrutinib-venetoklaks u prvoj liniji terapije, kao i nove podatke o MRD (minimalna rezidualna bolest) vođenom lečenju.
- Ažuriranje takođe obuhvata i odobrenje za BTKi (BTK inhibitor) zanubrutinib kod pacijenata koji do tog trenutka nisu lečeni od HLL, kao i za relapsiranu ili za refraktornu HLL.
- Uključeni su dodatni dokazi o vremenski ograničenoj kombinaciji venetoklaks plus anti-CD20 antitelo u prvoj liniji.
- Uključene su i opcije za kasnije linije terapije, a na osnovu tipa prethodnih linija lečenja.
- Preporuke su zasnovane na dostupnim naučnim podacima i kolektivnom stručnom mišljenju autora.
Lečenje rane bolesti
Binet stadijum A i B bez aktivne bolesti; Rai stadijum 0, I i II bez aktivne bolesti
Nedavno kliničko ispitivanje faze III koje je upoređivalo ibrutinib sa placebom kod asimptomatskih pacijenata sa Binet stadijumom A, i sa HLL sa nepovoljnim nivoom rizika, potvrdilo je da nema poboljšanja u ukupnom preživljavanju (OS) ranim započinjanjem lečenja kod asimptomatskih pacijenata u ranoj fazi bolesti, iako su periodi do sledećeg tretmana očekivano produženi. Samim tim, pristup “posmatraj i čekaj” i dalje predstavlja standard nege u ranoj fazi asimptomatske HLL.
Lečenje uznapredovale bolesti
Binet stadijum A i B sa aktivnom bolešću ili Binet stadijum C; Rai stadijum 0-II sa aktivnom bolešću ili Rai stadijum III-IV
Ažurirani algoritmi lečenja za terapiju prve linije (Slika 1) i terapiju relapsa (Slika 2)
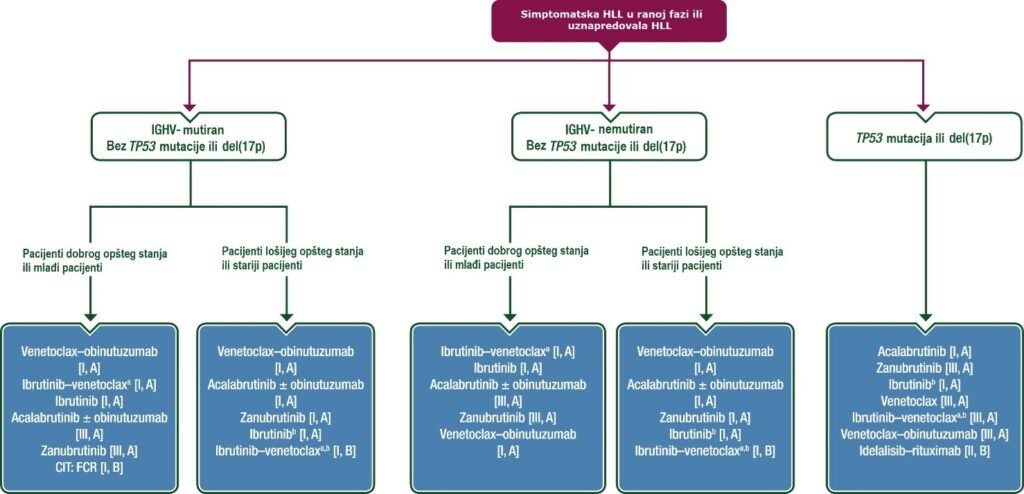
CIT, hemoimunoterapija; HLL, hronična limfocitna leukemija; del, delecija; FCR, fludarabin–ciklofosfamid–rituksimab; IGHV, varijabilnost teškog lanca imunoglobulina; MRD, minimalna rezidualna bolest.
aIbrutinib–venetoklaks terapija sa fiksnim trajanjem od 15 meseci ili vođena MRD-om.
bIbrutinib ili ibrutinib-venetoklaks treba pažljivo razmotriti kod starijih pacijenata sa srčanim komorbiditetima.
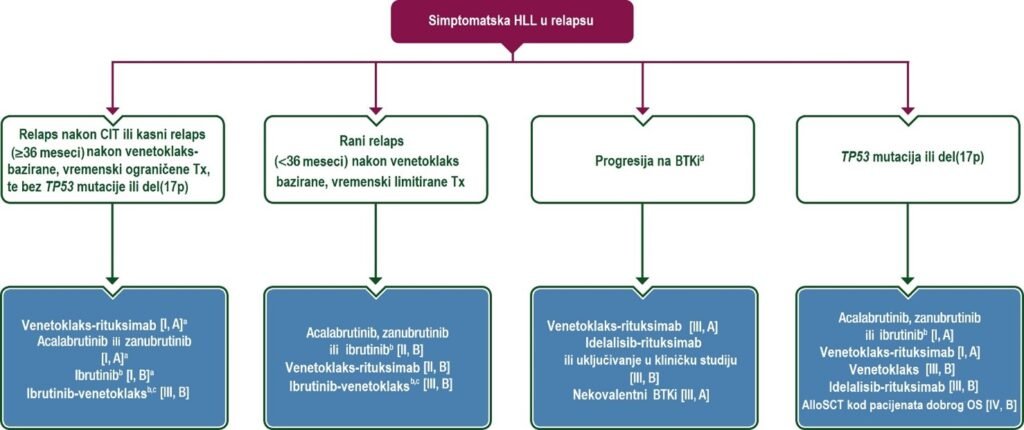
alloSCT, alogena transplantacija matičnih ćelija; BTKi, inhibitor Bruton tirozin kinaze; CIT, hemoimunoterapija; HLL, kronična limfocitna leukemija; del, delecija; EMA, Evropska agencija za lekove; FDA, Uprava za hranu i lekove USA; Tx, terapija; OS, opšte stanje.
aZa relaps nakon CIT-a, BTKi lekove ili venetoklaks–rituksimab treba uzeti ravnopravno u razmatranje, zavisno o komorbiditetima, komedikaciji, dostupnosti i preferencijama.
bIbrutinib treba pažljivo razmotriti, naročito kod starijih pacijenata s komorbiditetima srca.
cNije odobrena od EMA-e, nije odobrena od FDA-e u recidivu.
dAko kod pacijenta nakon prethodnog lečenja BTKi-jem, koje je prekinuto zbog nuspojava, dođe do pojave recidiva, može se razmotriti promena na drugi BTKi ili novi pokušaj terapije sa istim lekom [III, B].
Terapija prve linije
Dostupne su različite strategije lečenja za terapiju prve linije (vidi Sliku 1): (i) kontinuirano lečenje inhibitorima Bruton tirozin kinaze (BTKi), kao što su ibrutinib, akalabrutinib (sa ili bez obinutuzumaba) ili zanubrutinib, do progresije; ili (ii) vremenski ograničena terapija inhibitorom B-ćelijskog limfoma-2 (BCL2i) venetoklaksom u kombinaciji sa obinutuzumabom tokom 12 ciklusa, ili tri ciklusa monoterapije ibrutinibom nakon čega sledi ibrutinib-venetoklaks bilo fiksiranog trajanja od 12 ciklusa ili kao MRD vođena (minimalna rezidualna bolest) [koja donosi produženu korist, ali nije odobrena od strane Evropske agencije za lekove (EMA) ili Uprave za hranu i lekove (FDA)].
Vremenski ograničena hemoimunoterapija (CIT) kao što je fludarabin–ciklofosfamid–rituksimab (FCR) treba da se razmatra samo za pacijente sa dobrim genetskim profilom rizika [definisanim kao mutacioni status rearanžiranih gena za varijabilni region teških lanaca imunoglobulina (IGHV) i bez TP53 aberacija] i, pored toga, nekompleksni kariotip (definisan kao onaj sa manje od pet aberacija). Preživljavanje bez progresije (PFS) kod ostalih CIT režima (bendamustin–rituksimab, hlorambucil–obinutuzumab ili hlorambucil–rituksimab) je kraće u poređenju sa vremenski ograničenim ciljanim agensima; ovo još uvek nije pokazano za ukupno preživljavanje (OS) u većini studija. Optimalno savetovanje pacijenata (uključujući informacije o povezanom riziku od razvoja mijeloidnih neoplazmi) u pogledu kratkoročnih i dugotrajnih toksičnosti, snažno se preporučuje.
Procena pre lečenja, kada se bira jedna od preporučenih terapija, treba da uključi procenu IGHV i TP53 statusa – delecije u hromozomu 17p [del(17p)] i/ili mutacije TP53 – kao i faktore vezane za pacijenta poput komedikacije, komorbiditeta (posebno kardiološko ispitivanje kada se planira BTKi terapija), preferencije, dostupnost lekova i očekivanu terapijsku adherencu.
Analize podgrupa u E1912 studiji sa približno šestogodišnjim praćenjem koje su stratifikovale pacijente sa HLL prema njihovom IGHV mutacionom statusu pokazale su duži PFS (preživljavanje bez progresije) za kontinuirani ibrutinib-rituksimab u poređenju sa FCR protokolom, bez obzira na IGHV mutacioni status Međutim, u FLAIR studiji, nakon srednjeg vremena praćenja od 44 meseca, PFS se nije značajno razlikovao kod pacijenata sa mutiranim IGHV kada se uporede ova dva tretmana (HR 0,64, 95% CI 0,35-1,16, P = 0,15).
U petogodišnjoj analizi praćenja ELEVATE-TN studije, efikasnost za akalabrutinib–obinutuzumab pokazala se superiornijom u odnosu na hlorambucil–obinutuzumab (PFS: HR 0,11, 95% CI 0,07-0,67, P < 0,0001; OS55HR: HR: CI 0,30-0,99, P = 0,474). PFS (HR 0,21, 95% CI 0,15-0,30), ali ne i OS (ukupno preživljavanje), ono je bilo superiornije samo sa akalabrutinibom u odnosu na CIT. Studija, međutim, nije mogla da pokaže razliku u efikasnost između akalabrutiniba i kombinacije akalabrutinib–obinutuzumab. Zbog toga je efekat dodavanja obinutuzumaba akalabrutinibu još uvek nejasan, iako kombinacija pokazuje doslednu opservacionu korist, sa izuzetkom pacijenata sa TP53-aberantnom HLL.
Treći BTKi, zanubrutinib, odobren je od strane EMA i FDA u terapiji prve linije za HLL, a na osnovu rezultata SEQUOIA studije, koja je upoređivala kontinuirano davanje zanubrutiniba i bendamustin-rituksimab hemoimunoterapiju kod starijih pacijenata (PFS: HR 0,42, 95 % CI 0,28-0,63, dvostrano P < 0,0001).
Ispitivanja faze III (u relapsu ili refraktornom okruženju) sa direktnim poređenjem akalabrutiniba sa ibrutinibom, i zanubrutiniba sa ibrutinibom, pokazala su poboljšan profil kardiovaskularnih neželjenih efekata (za akalabrutinib, manje slučajeva atrijalne fibrilacije i hipertenzije; za zanubrutinib manje atrijalne fibrilacije) kod starijih pacijenata ili pacijenata sa kardiovaskularnim oboljenjima. Prema tome, akalabrutinib ili zanubrutinib su poželjniji od ibrutiniba, ako su dostupni, posebno kod pacijenata sa povećanim rizikom od srčane toksičnosti.
Podaci kod pacijenata sa dobrim opštim zdravstvenim stanjem stratifikovani prema starosti iz randomizovanog ispitivanja (GAIA-CLL13) potvrdili su da je 12 ciklusa venetoklaks–obinutuzumab superiornije od CIT (FCR ili bendamustin–rituksimab), kako u smislu nedetektabilnog MRD (uMRD) u perifernoj krvi u 15. mesecu (86,5% naspram 52,0% pacijenata, respektivno), tako i PFS nakon 3 godine (HR 0,42, 97,5% CI 0,26-0,68, P < 0,001).
Dodavanje ibrutiniba kombinaciji venetoklaks-obinutuzumab je dovelo do većeg procenta pacijenata sa uMRD (92,2%) i dužim PFS u poređenju sa CIT (HR 0,32, 97,5% CI 0,19-0,54, P < 0,0001). Incidencija teških infekcija bila je veća u trostrukoj terapiji (21,2%) u poređenju sa venetoklaks-obinutuzumabom (13,2%), te se na osnovu toga ovaj tretman u trenutku pisanja ovog ažuriranja ne može preporučiti.
Kada su pacijenti stratifikovani prema IGHV mutacionom statusu u ispitivanjima CLL14 i GAIA-CLL13, pokazalo se da su posebno oni sa nemutiranim IGHV statusom imali koristi kada su lečeni venetoklaks-obinutuzumab kombinacijom u poređenju sa drugim CIT opcijama. U CLL14 ispitivanju, venetoklaks –obinutuzumab je takođe bio bolji od CIT sa hlorambucil–obinutuzumabom kod pacijenata sa mutiranim IGHV statusom.
Vremenski ograničena kombinacija ibrutinib–venetoklaks sa 12 ciklusa (kojoj prethodi ibrutinib sa tri ciklusa) odobrena je u EU na osnovu faze III GLOW studije i vremenski ograničene kohorte faze II CAPTIVATE studije. GLOW je uključivala stariju populaciju i pokazano je da su pacijenti lečeni ibrutinib-venetoklaks kombinacijom imali duži PFS u poređenju sa hlorambucil-obinutuzumab kombinacijom (HR 0,216, 95% CI 0,131-0,357, P < 0,001). Populacija pacijenata CAPTIVATE studije je bila mlađa i potvrđena je dugotrajna remisija sa ovim režimom, uključujući pacijente sa nemutiranim IGHV i/ili TP53 aberacijom. Bilo je nekoliko ranih smrtnih slučajeva u GLOW ispitivanju koji su verovatno bili povezani sa kardiotoksičnošću, što nije primećeno u CAPTIVATE studiji. U ažuriranju GLOW studije, uočeno je da ibrutinib–venetoklaks imaju bolje OS vrednosti u odnosu na hlorambucil–obinutuzumab. Međutim, treba pažljivo proceniti starije pacijente prilikom razmatranja opcije njihovog lečenja kombinacijom ibrutinib–venetoklaks.
Pacijenti koji primaju vremenski ograničenu terapiju i terapiju fiksnog trajanja, posebno oni sa HLL i nemutiranim IGHV statusom, mogu imati kraći PFS u poređenju sa kontinuiranom terapijom. S druge strane, oni imaju prednost kod potencijalnog ponovnog administriranja iste terapije, i kod pravljenja pauze u terapiji, a do danas nema podataka koji pokazuju da će se kraći PFS iskazati kroz umanjenje očekivano trajanje života. Randomizirana ispitivanja će, međutim, pokazati koji pacijenti imaju korist od kontinuiranog lečenja.
Dodatna kohorta u FLAIR-u otkrila je da je kombinacija ibrutinib–venetoklaks sa personalizovanim trajanjem na osnovu merljive MRD doveo do značajnog poboljšanja PFS u poređenju sa FCR (HR 0,13, 95% CI 0,07-0,24, P < 0,001) kao i OS ( HR 0,31, 95% CI 0,15-0,67) u mlađoj populaciji sa dobrim opštim zdravstvenim stanjem. Srednja dužina trajanja lečenja ibrutinib-venetoklaksom bila je 27 ciklusa.
Iako CIT može biti opcija za pacijente sa povoljnim genetskim profilom, ciljane terapije bi ipak trebalo da budu prvi izbor zbog poboljšane PFS i ukupnog preživljavanja (OS). Prilikom odlučivanja između vremenski ograničenih kombinacija ibrutinib – venetoklaks ili venetoklaks –obinutuzumab u odnosu na kontinuirane BTKi terapije, vremenski ograničena terapija je opcija izbora jer je povezana sa smanjenom toksičnošću i ponovni tretman bi bio moguć u slučaju relapsa. Uočeni su dugi intervali bez terapije sa vremenski ograničenom terapijom, posebno kod HLL sa povoljnim profilom rizika, što je dodatna korist za PFS (Slika 1).
Pacijenti sa mutacijom TP53 i/ili del(17p) treba da dobiju terapiju prve linije sa BTKi lekovima (Slika 1). Monoterapija venetoklaksom (kao kontinuirana terapija), ibrutinib-venetoklaks, posebno u mlađoj populaciji, ili venetoklaks-obinutuzumab mogu se koristiti alternativno, iako imaju kraće trajanje odgovora u poređenju sa drugim HLL podgrupama. Uticaj kontinuiranog lečenja BTKi prve linije naspram vremenski ograničene kombinacije (venetoklaks– obinutuzumab ili ibrutinib-venetoklaks) na ukupno preživljavanje (OS), međutim, još uvek nije potpuno jasan.
Terapija relapsa i refraktornih oblika bolesti
CIT ne treba davati u relapsu ako su dostupne ciljane terapije, pošto je CIT inferiorna kada je reč o PFS i OS (Slika 2).
Za pacijente kod kojih je došlo do relapsa nakon CIT-a ili kasno nakon vremenski ograničene kombinovane terapije zasnovane na venetoklaksu, postoje dve glavne opcije: (i) venetoklaks–rituksimab kao vremenski ograničena terapija; ili (ii) akalabrutinib, zanubrutinib ili ibrutinib kao kontinuirana terapija.
MURANO studija pokazala je superiorne PFS i OS rezultate kod pacijenata sa relapsom ili kod refraktornim pacijentima koji su lečeni kombinacijom venetoklaks-rituksimab u poređenju sa kombinacijom bendamustin-rituksimab. Još uvek nije jasno koliko dugo treba da traje minimalno trajanje remisije za preporuku za ponovnu terapiju venetoklaks-CD20-antitelom.
Četvorogodišnje praćenje ASCEND istraživanja pokazalo je da je akalabrutinib zadržao efikasnost u poređenju sa idelalisib-rituksimab ili bendamustin-rituksimab kombinacijama. Takođe je uočeno manje kardiovaskularnih neželjenih događaja u poređenju sa ibrutinibom. Zanubrutinib je pokazao superiorniji PFS (preživljavanje bez remisije) od ibrutiniba u ALPINE studiji, te su zato EMA i FDA odobrile zanubrutinib kod relapsa HLL. Nema podataka koji direktno upoređuju acalabrutinib i zanubrutinib, već samo indirektna poređenja.
Iako su obećavajući rezultati za ibrutinib-venetoklaks objavljeni za relapsnu HLL, ova kombinacija tek treba da bude procenjena u randomizovanim studijama faze III. Vremenski ograničeni režim za ibrutinib-venetoklaks kraći je od venetoklaks-rituksimab režima, ali sa sličnim PFS-om. Ovo bi moglo predstavljati prednost u lečenju relapsa, čak i kada se uzmu u obzir ograničenja uporednih studija, kao i činjenica da su svi pacijenti u oba ispitivanja primali CIT, a ne ciljanu terapiju u prethodnim linijama. Detaljniji podaci o tretmanu relapsa van ovog režima još uvek nisu dostupni, ali se pokazalo da je ponovno lečenje izvodljivo i efikasno.
Postoje ograničeni podaci bez dugotrajnog praćenja pacijenata sa dugotrajnom remisijom nakon davanja venetoklaks–obinutuzumab kombinacije u prvoj liniji, o njihovom ponovnom izlaganju režimu koji sadrži venetoklaks plus anti-CD20 antitelo.
Za izbor između ovih modaliteta lečenja, isti aspekti kao i za prvu terapijsku liniju trebaju biti razmotreni sa pacijentom (trajanje lečenja, način primene, komplijansa, broj i složenost kliničkih kontrola i profil neželjenih efekata s obzirom na postojeće komorbiditete). Takođe treba razmotriti uticaj prethodnih terapija na očekivani PFS kod različitih opcija lečenja, kao što je prethodno navedeno.
Kod pacijenata koji imaju relaps nakon prethodnog tretmana BTKi lekovima, a koji je zaustavljen zbog neželjenih efekata, postoje podaci koji potvrđuju da bi prelazak na drugi BTKi lek mogla biti izvodljiva (npr. prelazak sa ibrutiniba na acalabrutinib ili zanubrutinib). Prelazak na druge klase lekova ili ponavljanje iste terapije takođe može biti opcija.
U slučaju progresije bolesti tokom BTKi terapije, prelazak na terapiju zasnovanu na venetoklaksu je poželjan izbor.
PREPORUKE
Terapija prve linije


Terapija relapsa i refraktornih oblika bolesti


IZVOR: Eichhorst B, Ghia P, Niemann CU, Kater AP, Gregor M, Hallek M, Jerkeman M, Buske C, on behalf of the ESMO Guidelines Committee, ESMO Clinical Practice Guideline interim, update on new targeted therapies in the first-line and at relapse of chronic lymphocytic leukaemia Annals of Oncology (2024), doi: https://doi.org/10.1016/j.annonc.2024.06.016.


